随着中国人口结构不断老龄化,退行性腰椎疾病如腰椎滑脱、腰椎间盘突出、腰椎管狭窄等的发病率日渐增高。对于需要手术的患者,腰椎椎间融合术是其主要治疗选择。目前主要的治疗方式为后路腰椎椎间融合术(posterior lumbar interbody fusion,PLIF),其临床疗效确切,但存在创伤大,术后恢复慢等问题[1]。而微创经椎间孔入路腰椎椎间融合术(minimally invasive surgery-transforaminal lumbar interbody fusion,MIS-TLIF)采用微创方法,可减少手术创伤,但目前关于其适应症及临床疗效的相关研究仍较少。笔者通过回顾分析2017年6月至2018年12月,在本科室采用MISTLIF治疗的退行性腰椎疾病患者30例,与同期经PLIF手术治疗的30例患者进行比较。探讨MISTLIF手术相对于PLIF手术的优势。
1 资料与方法
1.1 一般资料
通过纳入本单位2017年6月至2018年12月脊柱外科收治的腰椎退行性疾病患者,均符合入选标准,在患者及家属签署知情同意书后,每组各纳入30例患者,分别采用MIS-TLIF和PLIF进行手术,两组手术为同组医生施行。本临床研究获揭阳市人民医院伦理委员会批准通过,并严格按照伦理要求执行。
本研究纳入标准为:①临床症状为严重的腰痛或者腰腿痛,伴或不伴有间歇性跛行;②影像学表现为单节段腰椎滑脱(Ⅰ~Ⅱ度)、腰椎管狭窄、腰椎间盘突出,且与临床症状相符;③经过3个月以上的保守治疗无明显效果,症状反复发作;④无精神类疾病,能耐受手术及配合随访者。排除标准为:①经症状、体征、影像学检查判断为多节段腰椎病变者;②有腰部手术、骨折、肿瘤、感染病史者;③患有其他严重的系统性疾病患者;④伴有椎体先天发育异常或退变性脊柱侧弯或严重畸形者。
1.2 手术方法
传统开放PLIF手术:行常规腰椎术前准备,全麻后取俯卧位,腹部垫空,使脊柱呈后伸状态。取后正中切口,自棘突向两侧剥离椎旁肌肉和软组织,C臂透视确认病变节段后置入椎弓根螺钉,并再次确认螺钉位置良好。切除病变椎间隙上位椎体棘突和部分椎板,切下的骨组织去除软组织后制成骨粒。咬除黄韧带,清除周围骨赘。将神经根和硬膜囊拉向中线,清除椎间盘和软骨终板,将部分骨粒置入椎间隙前方,准备合适高度的融合器后置入椎间隙,C臂确认椎间融合器位置合适。裁剪合适的钛棒并加压固定。探查无活动性出血,置入引流管,逐层缝合切口。
Quadrant通道辅助MIS-TLIF手术[2]:行常规腰椎术前准备,全麻后取俯卧位,C臂透视确认病变节段及上下椎弓根中心点并做好体表标记,依次切开皮肤、皮下组织及腰背筋膜,钝性分离多裂肌和最长肌间隙,显露关节突关节,放置导杆,逐级放置软组织扩张套筒,安装Quadrant通道,放置合适长度的可扩张叶片并固定于自由臂上。去除套筒,适度撑开叶片,并行固定,拧紧自由臂各关节,置入冷光源及侧方拉钩显露术区,充分暴露椎板及关节突关节,C臂确认节段后行椎间孔减压,显露并切除肥厚的黄韧带、增生的关节突,髓核钳取出椎间盘髓核组织,处理椎间隙及软骨终板,将咬除的椎板及上下关节突骨组织修成骨粒并放置于椎间融合器中,植入椎间隙前半部分。去除通道后置入椎弓根钉,对侧仅行置钉,安装连接棒并加压固定,再次探查后生理盐水冲洗术野,放置引流管,逐层缝合切口。
1.3 疗效评定
所有患者均进行随访,时间为1年。记录两组病例:①手术时间、术中出血量、术后引流量、卧床时间及住院时间;②术前、术后1、6、12月ODI评分[3](Oswestry disability index,ODI);术前、术后1、6、12 月 腰 腿 痛 VAS 评 分[4](visual analogue scale,VAS);③复查X线评估末次随访腰椎融合情况。其中腰椎融合率采用Bridwell方法评估[5],滑脱分度采用Meyerding方法进行评分[6]。
椎体滑脱患者回复率计算方法为,定义病变节段上位椎体后缘与下位椎体后缘距离为滑脱距离:(术前滑脱距离-术后滑脱距离)/术前滑脱距离。
1.4 统计学方法
本组数据均由SPSS 22.0软件进行处理分析,融合率采用比率(%)的形式表示。计量资料采用均数±标准差(x±s)的形式表示。其中两组间计量资料比较采用t检验,多组间比较采用方差分析;计数资料比较采用卡方检验,以α=0.05为标准,P<0.05为差异具有统计学意义。
2 结 果
术程顺利,术后患者生命体征平稳,未出现心脑血管意外。两组基线资料(性别、年龄、病变类型、病变节段)比较,差异无统计学意义,两组资料具可比性。两组围手术期资料比较可见MIS-TLIF组手术时间、术中出血量、术后引流量、术后卧床时间、术后住院时间均明显小于PLIF组,差异具有统计学意义(P<0.05)。而术后ODI、VAS评分术后1月、6月、1年均较术前改善,差异具有统计学意义(P<0.05);两组术后1月、6月比较,MIS-TLIF组ODI、VAS评分均优于PLIF组,差异具有统计学意义(P<0.05),而术后1年两组比较差异无统计学意义(P>0.05)。两组术后1年椎间融合分级比较差异无明显统计学意义(P>0.05)。PLIF手术滑脱患者滑脱回复率优于MIS-TLIF组,差异具有统计学意义(P<0.05)。对于围手术期并发症,PLIF组术中1例硬膜囊破裂,可经缝合修补,术后出现脑脊液漏,予放置引流5天后拔除,术后恢复良好。一例患者术后卧床7天,出现肺部感染,经保守治疗可治愈。TLIF组术后1例患者出现对侧的神经根症状,经保守治疗可好转。一例患者术后X线发现置钉超过椎弓根外缘,但不影响手术疗效。而两组均未发生定位错误、神经损伤、手术部位感染、内固定物松脱等并发症,术后临床疗效良好,无需再次手术。
表1 两组患者基线资料比较
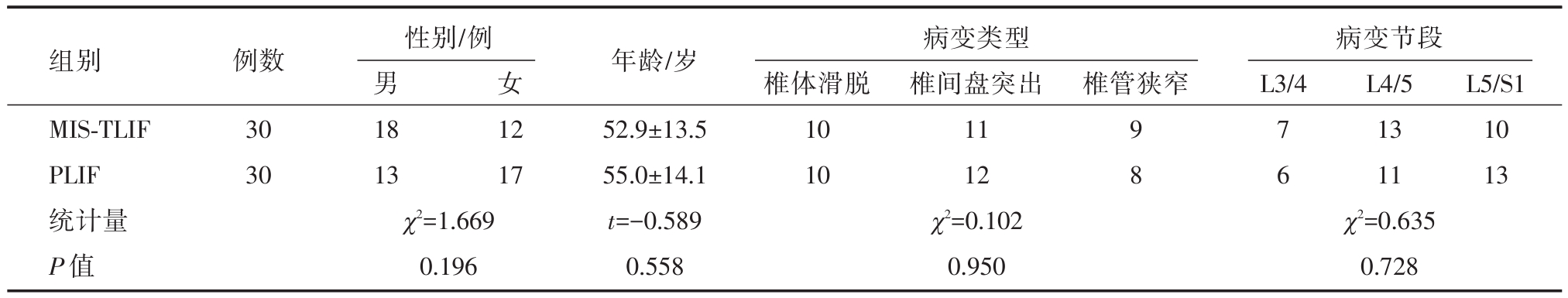
组别MIS-TLIF PLIF统计量P值例数30 30性别/例男18 13 χ2=1.669 0.196女椎管狭窄病变节段L3/4 12 17年龄/岁52.9±13.5 55.0±14.1 t=-0.589 0.558病变类型椎体滑脱10 10 χ2=0.102 0.950椎间盘突出11 12 9 7 1310 8 61113 χ2=0.635 L4/5L5/S1 0.728
表2 两组患者围手术期资料比较
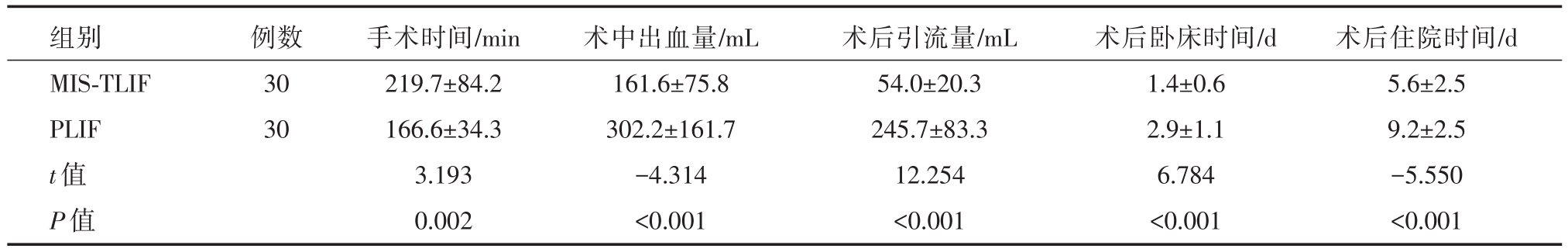
组别MIS-TLIF PLIF t值P值例数30 30手术时间/min 219.7±84.2 166.6±34.3 3.193 0.002术中出血量/mL 161.6±75.8 302.2±161.7-4.314<0.001术后引流量/mL 54.0±20.3 245.7±83.3 12.254<0.001术后卧床时间/d 1.4±0.6 2.9±1.1 6.784<0.001术后住院时间/d 5.6±2.5 9.2±2.5-5.550<0.001
表3 两组患者术后疗效比较
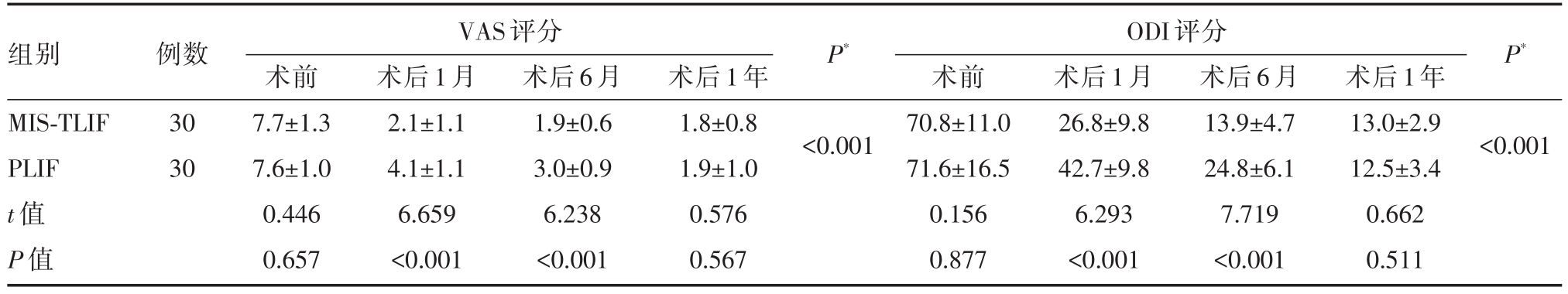
注:*多组间方差分析,术后各组与术前VAS、ODI评分相比P均小于0.001
组别MIS-TLIF PLIF t值P值例数30 30 VAS评分ODI评分术前7.7±1.3 7.6±1.0 0.446 0.657术后1月2.1±1.1 4.1±1.1 6.659<0.001术后6月1.9±0.6 3.0±0.9 6.238<0.001术后1年1.8±0.8 1.9±1.0 0.576 0.567 P*P*<0.001术前70.8±11.0 71.6±16.5 0.156 0.877术后1月26.8±9.8 42.7±9.8 6.293<0.001术后6月13.9±4.7 24.8±6.1 7.719<0.001术后1年13.0±2.9 12.5±3.4 0.662 0.511<0.001
表4 两组患者椎间融合率及滑脱患者相关统计
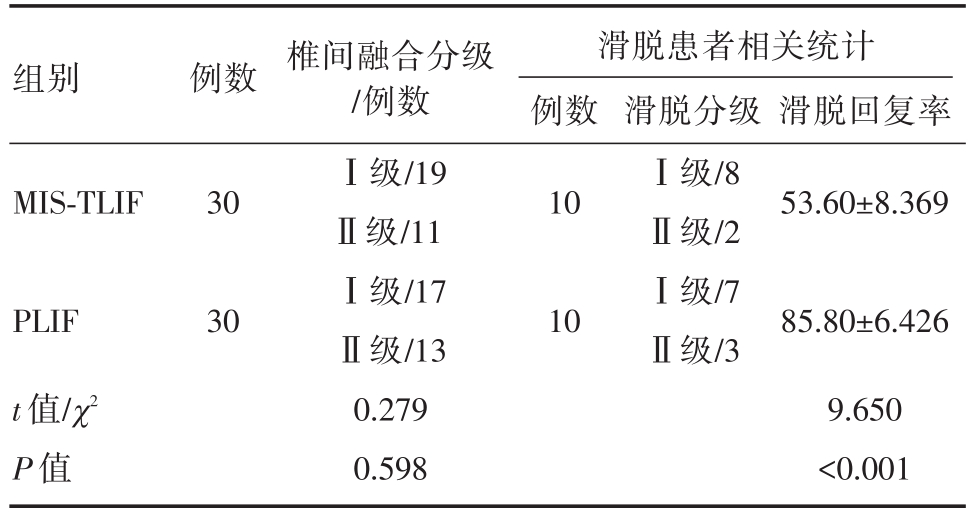
组别 例数 滑脱回复率滑脱患者相关统计例数MIS-TLIF 301053.60±8.369 PLIF t值/χ2 P值30椎间融合分级/例数Ⅰ级/19Ⅱ级/11Ⅰ级/17Ⅱ级/13 0.279 0.598 10滑脱分级Ⅰ级/8Ⅱ级/2Ⅰ级/7Ⅱ级/385.80±6.426 9.650<0.001
3 讨 论
腰椎退行性疾病包括腰椎间盘突出、腰椎滑脱、腰椎管狭窄等疾病随着人口老年化到来日渐增多。对于需手术治疗的患者,目前存在多种手术方式,如PLIF、前路腰椎椎间融合术(anterior lumbar interbody fusion,ALIF)、MIS-TLIF 等 技术[7]。PLIF手术是椎间融合术的经典术式,但临床研究发现,其对后路结构及脊柱旁肌的损害较大,且在术中需将硬膜囊牵拉过中线,可能造成神经根或硬膜囊的损伤,本研究PLIF组术中1例发生硬膜囊撕裂[1]。ALIF可减少神经牵拉,但必须经腹膜后入路,大多数脊柱外科医生对此入路不熟悉,可引起腹膜后血肿、逆行性射精等并发症,目前较少使用[8]。
经椎间孔入路手术理论上可减少对后路结构的破坏,减少神经牵拉,通过逐级扩张通道,可减少脊柱旁肌的损伤,并尽可能保护患侧脊柱后方结构,对侧则可完整保留[9]。本研究中MIS-TLIF组通过单侧减压方式达到手术目的,通道下进行手术,可直接对病变结构减压,尽可能少地破坏后柱稳定结构,术中出血量及术后引流量较PLIF组减少。
而MIS-TLIF手术时间比组PLIF组长,这与MIS-TLIF组术中在有限空间操作以及需术中反复X线照射确认有关。也与本单位开展例数较少,尚处于学习曲线初期相关。Silva等人[10]绘制MISTLIF组学习曲线发现,进过最初的44例患者后,手术时间渐下降并趋于稳定,且往后患者的长期手术效果、神经症状较早期患者改善。本研究手术时间较文献手术时间较长,仍有进一步改进空间。
本研究中,MIS-TLIF组术后1月、6月ODI、VAS评分均优于PLIF组(P<0.05),且术后卧床时间、术后住院时间均明显小于PLIF组(P<0.05)。推测与术中较少牵拉多裂肌有关,部分PLIF术后患者因腰痛而导致下地时间推迟,延迟康复。Fan S等[11]通过对比经通道PLIF和开放PLIF发现,术后1年MR显示经通道PLIF病变多裂肌横断面积萎缩明显少于开放PLIF(12.2%vs 36.8%,P<0.05),多裂肌T2信号改变明显较少(10.6%vs 34.4%,P<0.05),且与术后肌酐、ODI、VAS评分明显相关。提示术中过度牵拉损伤多裂肌,导致术后腰痛症状发生[11],与本研究结论相符。
两组术后1年VAS、ODI差异无统计学意义,与荟萃分析结果相符[7]。经过1年后,虽多裂肌可因失神经化而萎缩[11],但并不影响临床效果。尽管如此,在短期疗效方面,MIS-TLIF仍优于开放PLIF,有利于患者术后快速恢复至术前状态。
但两组术后1年椎间融合分级差异无统计学意义。理论上MIS-TLIF对脊柱血运保护较好,有助于融合。对于腰椎滑脱患者,本研究例数较少,但可见PLIF组滑脱回复率优于MIS-TLIF组,这可能与MIS-TLIF组保留的韧带和肌肉张力较大而影响复位有关。文献报道,对于重度滑脱患者,原位融合可达到75%~80%的患者满意率[12]。而对于轻度腰椎滑脱患者,原位融合可达到与复位患者同样的手术疗效[13]。虽然MIS-TLIF滑脱复位率不如PLIF组,但对于轻度腰椎滑脱患者已可达到手术目的,并可减少手术创伤。
两组术后并发症发生率相当。对于对侧椎间孔狭窄的患者,通道下不能直接减压对侧神经根,而只能通过放置合适大小的椎间融合器进行间接减压。本研究MIS-TLIF组一例对侧神经根症状发生,回顾发现其术前椎间孔狭窄,术后神经根激惹而出现症状。在Yang Y[14]等人的研究中,对侧椎间孔过小是MIS-TLIF术后对侧神经根症状出现的危险因素。我们建议对侧椎间孔过于狭窄时,术中尽可能恢复椎间高度或行对侧椎间孔直接减压。
综上所述,MIS-TLIF术后1年可达到与PLIF组相同的临床疗效和融合率,但6月内VAS、ODI评分相比更优,术后卧床时间及住院时间较短,有利于患者术后快速康复。但手术时间相比较长,且滑脱患者回复率较小。我们认为,与之相比,减少手术创伤、保护后柱结构更为重要,且可随着经验积累进一步改进。
参考文献
[1] Craig Humphreys S,Hodges SD,Patwardhan AG,et al.Comparison of Posterior and Transforaminal Approaches to Lumbar Interbody Fusion[J].Spine,26(5):567-571.
[2] Lin GX,Quillo-Olvera J,Jo HJ,et al.Minimally Invasive Transforaminal Lumbar Interbody Fusion:A Comparison Study Based on Endplate Subsidence and Cystic Change in Individuals Above and Below the Age of 65[J].World Neurosurg,2017,106:174-184.
[3] Fairbank JC.The Oswestry Disability Index[J].J Neurosurg Spine,2014,20(2):239-241.
[4] Huskisson EC,Jones J,Scott PJ.Application of visual-analogue scales to the measurement of functional capacity[J].Rheumatol Rehabil,1976,15(3):185-187.
[5] Bridwell KH,Lenke LG,Mcenery KW,et al.Anterior fresh frozen structural allografts in the thoracic and lumbar spine.Do they work if combined with posterior fusion and instrumentation in adult patients with kyphosis or anterior column defects?[J].Spine(Phila Pa 1976),1995,20(12):1410-1418.
[6] Henry W.Low backache and sciatic pain associated with spondylolisthesis and protruded intervertebral disc,incidence,significance,and treatment[J].JBJS,1941,23:461-470.
[7] Goldstein CL,Macwan K,Sundararajan K,Rampersaud YR.Perioperative outcomes and adverse events of minimally invasive versus open posterior lumbar fusion:meta-analysis and systematic review[J].J Neurosurg Spine,2015,24(3):416-427.
[8] Udby PM,Bech-Azeddine R.Clinical outcome of stand-alone ALIF compared to posterior instrumentation for degenerative disc disease:A pilot study and a literature review[J].Clin Neurol Neurosurg,2015,133:64-69.
[9] Rouben D,Casnellie M,Ferguson M.Long-term Durability of Minimal Invasive Posterior Transforaminal Lumbar Interbody Fusion:A Clinical and Radiographic Follow-up[J].J Spinal Disord Tech,2011,24(5):288-296.
[10] Silva PS,Pereira P,Monteiro P,et al.Learning curve and complications of minimally invasive transforaminal lumbar interbody fusion[J].Neurosurg Focus,2013,35(2):E7.
[11] Fan SW,Hu Z,Zhao F,et al.Multifidus muscle changes and clinical effects of one-level posterior lumbar interbody fusion:minimally invasive procedure versus conventional open approach[J].Eur Spine J,2010,19(2):316-324.
[12] Lamberg T,Remes V,Helenius I,et al.Uninstrumented in situ fusion for high-grade childhood and adolescent isthmic spondylolisthesis:long-term outcome[J].J Bone Joint Surg,2007,89(3):512-518.
[13] Bai X,Chen J,Liu L,et al.Is reduction better than arthrodesis in situ in surgical management of low-grade spondylolisthesis?A system review and meta analysis[J].Eur Spine J,2016,26(3):1-13.
[14] Yang Y,Liu Z,Zhang L,et al.Risk factor of contralateral radiculopathy following microendoscopy-assisted minimally invasive transforaminal lumbar interbody fusion[J].Eur Spine J,2018,27(8):1925-1932.

